Ксенон
Содержание:
- Получение
- Получение
- Получение
- Устройство и принцип работы
- Свойства
- Применение
- Применение
- Получение
- Чем отличается ксенон от биксенона?
- Распространённость
- Изотопы
- Ксенон-135
- Свойства
- Как установить
- Устройство ксеноновой лампы.
- Распространённость[править | править код]
- Химические свойства
- Применение
- Применение ксенона:
- История[править | править код]
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1—0,2 % криптоно-ксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В дальнейшем ксеноно-криптоновый концентрат может быть разделён дистилляцией на криптон и ксенон, подробнее см. .
Из-за своей малой распространенности ксенон гораздо дороже более легких инертных газов.
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1—0,2 % криптоно-ксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В дальнейшем ксеноно-криптоновый концентрат может быть разделён дистилляцией на криптон и ксенон, подробнее см. .
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0,1—0,2 % криптоно-ксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В дальнейшем ксеноно-криптоновый концентрат может быть разделён дистилляцией на криптон и ксенон, подробнее см. Криптон#Получение.
Из-за своей малой распространённости ксенон гораздо дороже более лёгких инертных газов. В 2009 году цена ксенона составляла около 20 евро за литр газообразного вещества при стандартном давлении.
Устройство и принцип работы
В конструкции ксеноновых ламп нет спирали накаливания. Она заменена электрическим разрядом, который появляется между электродами, помещенными в эллиптическую колбу. Именно в ней находится газ ксенон, смешанный с солями металлов. Смесь закачивают под давлением. При эксплуатации изделия образуется сильный пучок света, превосходящий по интенсивности галогенные лампочки. Поэтому с ксеноновым светом устанавливают специальные линзы и рефлектор.
Предотвратить ослепление других водителей на дороге помогает оптика с ксеноном, которая оборудуется омывателем фар и динамическим корректором. Последний имеет довольно высокую цену, однако особенно необходим при таком тюнинге. Омыватель фар исключает рассеивание света через забрызганные грязью стекла. При установке ксеноновой оптики на подержанную машину регулировку света проводят на стационарном аппарате.
Цвета ламп зависит от температуры (измеряется в кельвинах), до которой нагревается газ в колбе. Ассортимент современных источников света включает следующие виды:
- Ксенон 3000к светит теплым желтоватым оттенком – его можно устанавливать только в противотуманки.
- 4300к имеет бело-молочный свет – его устанавливают на заводе.
- 5000к – белый.
- 6000к – голубой кристалл.
Поскольку в ксеноновых лампах отсутствует нить накаливания, в первые годы их использования возникали трудности с включением ближнего и дальнего света. Ксеноновые источники света устанавливали только на машины с 4 рефлекторами. Однако современная оптика представлена двумя конструкциями биксенона. В простых изделиях колбы с ксеноном смещаются в одном цоколе. Биксеноновые фары – это устройства, оснащенные шторкой для неполного закрывания рефлектора. Современная оптика имеют привод, который двигает лампу горизонтально, обеспечивая разные режимы освещения дороги.
Маркировка
Обычные лампочки, согласно ГОСТу, имеют следующую маркировку:
- C – ближний свет;
- R – дальний;
- CR – двухрежимный.
В обозначении фар для ксенона должна быть написана буква «D», а для галогена – «H». Если владелец автомобиля устанавливает такие лампы, он должен убедиться, что на оптике имеются соответствующие обозначения.
На многих машинах маркировка фар находится на их стеклянной части, сзади или сверху. В последних случаях потребуется открыть капот. На некоторых моделях понадобится снять фару. Стоит рассмотреть изделие с маркировкой:
- Обозначение «1» расположено слева и указывает на тип фары: A – боковые, B – противотуманные, C – ближнего освещения, R – дальнего, CR или C/R – соответственно, ближнего и дальнего.
- Обозначение «2» относится к типу ламп, к примеру, HCR или DC.
- Цифра «3» имеет несколько расшифровок и выглядит как «E15». Первая буква обозначает международный стандарт (E – для машин европейского производства, DOT или SAE – для авто из США). Рядом с буковой находится цифра – код страны-производителя.
- Обозначение «4» выглядит как стрелка, одно- или двунаправленная. Если она указывает вправо – значит, оптика предназначена для стран с правосторонним движением. В универсальных изделиях фары имеют двунаправленные стрелки.
Сравнение с другими видами фар и что лучше
Фары ксенон, как и светодиодные лед лампы, постепенно заменяют галогеновые. Их свет можно сравнить с дневным, тогда как при работе старых ламп он имеет желтый оттенок и быстрее утомляет глаза водителя. Свет от ламп накаливания, как и от галогеновых, рассеивается благодаря определенной конструкции фар. Ксеноновый образует пучок лучей за счет применения линз.
Срок эксплуатации ксеноновых источников света намного больше, чем у остальных – около 3 тыс. часов. Галогеновые лампочки могут прослужить лишь 500 часов. Различия кроются и в конструкции ламп, ведь при ксеноновом освещении свет создается за счет работы колбы с закачанным газом, а в галогеновых накаливается спираль из специального сплава. Светодиодные фары лед сотрудники ГИБДД приравнивают к галогеновым.
Свойства
Физические
Гранецентрированная кубическая структура ксенона
Температура плавления −112 °C, температура кипения −108 °C, свечение в разряде фиолетовым цветом.
Заполненная ксеноном газоразрядная трубка
Химические
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Реакции со фтором:
-
- Xe+F2→XeF2{\displaystyle {\mathsf {Xe+F_{2}\rightarrow XeF_{2}}}} при комнатной температуре и УФ-облучении или при 300—500ºС, p
-
- Xe+2F2→XeF4{\displaystyle {\mathsf {Xe+2F_{2}\rightarrow XeF_{4}}}} при 400ºС, р; примеси XeF2, XeF6
-
- Xe+3F2→XeF6{\displaystyle {\mathsf {Xe+3F_{2}\rightarrow XeF_{6}}}}при 300ºС, р; примесь XeF4
Применение
Ксеноновая лампа-вспышка
Прототип ионного двигателя на ксеноне
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы (127Xe, 133Xe, 137Xe и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателейкосмических аппаратов.
- В конце XX века был разработан метод применения ксенона в качестве средства для наркоза и обезболивания. Первые диссертации о технике ксенонового наркоза появились в России в 1993 г. В 1999 году ксенон был разрешён к медицинскому применению в качестве средства для ингаляционного наркоза.
- В наши дни ксенон проходит апробацию в лечении зависимых состояний.
- Жидкий ксенон иногда используется как рабочая среда лазеров.
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а также в качестве компонентов газовых смесей для лазеров.
- В изотопе 129Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния, называемого гиперполяризацией.
- Для транспортировки фтора, проявляющего сильные окисляющие свойства.
Применение
Ксеноновая лампа-вспышка
Прототип ионного двигателя на ксеноне
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы (127Xe, 133Xe, 137Xe и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов. В 2020 году Роскосмос заявил о начале строительства космического аппарата «Нуклон» с ядерной силовой установкой. Ксенон будет использоваться в качестве рабочего тела реактивного двигателя.
- В конце XX века был разработан метод применения ксенона в качестве средства для наркоза и обезболивания. Первые диссертации о технике ксенонового наркоза появились в России в 1993 году. В 1999 году ксенон был разрешён к медицинскому применению в качестве средства для ингаляционного наркоза.
- В наши дни[] ксенон проходит апробацию в лечении зависимых состояний.
- Жидкий ксенон иногда используется как рабочая среда лазеров.
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а также в качестве компонентов газовых смесей для лазеров.
- В изотопе 129Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния, называемого гиперполяризацией.
- Ксенон используется для наполнения ячейки Голея в детекторах терагерцевого излучения.
- Для , проявляющего сильные окисляющие свойства.
Получение
Впервые синтез XeF2 провёл Червик Виикс в 1962 году.
Синтез проводят из простых веществ при нагревании, ультрафиолетовом облучении или действии электрического разряда:
-
- Xe + F2 → XeF2
Продукт конденсируют при −30 °C. Очистку проводят методом фракционной дистилляции.
Механизм данной реакции достаточно интересный, и, по-видимому, в нём как-то участвуют молекулы фтороводорода, которыми обычно загрязнён газообразный фтор. Это обнаружили Шмарк и Лютар, которые для синтеза использовали неочищенный от водорода фтор, и при этом скорость реакции выросла в 4 раза по сравнению с использованием чистого фтора.
Также существует метод получения дифторида ксенона из фторида кислорода II и ксенона. Для этого смесь газов помещают в никелевый сосуд и нагревают до 300 °C под давлением:
-
- 2 Xe + 2 OF2 → 2 XeF2 + O2
В России налажено производство дифторида ксенона на Сибирском химическом комбинате.
Дифторид ксенона образуется также при реакции ксенона с диоксидифторидом при −120 °C.
Чем отличается ксенон от биксенона?
Автомобилисты практичны. Они всегда стараются обеспечить полную безопасность при движении. Это особенно актуально в ночное время, когда видимость сильно ограничена. К тому же вождению сильно мешают ослепляющие фары встречных машин. Были времена, когда устанавливались дополнительные фары на автомобиль. Ведь серьезные аварии часто случаются из-за недостатка освещения. Но в наши дни эта проблема решается иным способом. Появились газоразрядные лампы, которые имеют уникальные показатели, увеличивая яркость почти в 3 раза. Это ксеноновые лампы, в которых используется инертный газ. Различают ксеноновые и биксеноновые лампы. Так в чем же разница между ними?
Определение ксенона и биксенона
Ксеноновая лампа наполнена газом, от обычных ламп она отличается главным образом тем, что не имеет нити накаливания. Принцип работы лампы заключается в следующем: между двумя электродами проходит высокое напряжение, это вызывает свечение газа, находящегося в лампе. Ксеноновая лампа обладает постоянным излучением, менять его направление не способна.
Биксеноновая лампа является той же ксеноновой лампой, но снабжена механизмом, который может менять направление свечения. В роли такого механизма выступает металлическая шторка, которая перемещается под действием магнита, открывая при этом разные участки лампы.
Сравнение ксенона и биксенона
В чем же отличия биксеноновых ламп от ксеноновых? Если говорить по-простому, то ксеноновые лампы могут давать только ближний свет, а вот технология биксеноновых ламп устроена таким образом, что свет здесь можно переключать с ближнего на дальний. Биксеноновое освещение построено на изменении фокусного расстояния (дальний и ближний фокус) обычной ксеноновой лампы, которая может менять свое положение, используя «плавающую колбу» или переключающий рефлектор-шторку.
Ксеоновыми фарами оснащаются представительские автомобили, которые оборудованы чуть ли не проблесковыми маячками. Такие фары обеспечивают отличное освещение дороги. Заменив привычные галогенки на ксеон, вы просто удивитесь, как могли передвигаться без них раньше. Не забывайте, что яркость света – непременное условие безопасной езды. Свет таких ламп не ослепляет встречных водителей, они очень экономичны и служат минимум два года.
У ксенона и биксенона принцип формирования свечения одинаковый, по показателям яркости свечения, надежности и экономичности они не различаются
Но если в вашей машине не предусмотрена раздельная оптика, есть смысл обратить внимание на биксеоновые лампы. Установить их можно и самостоятельно, если следовать инструкции
При покупке стоит обратить внимание на обозначение цоколя лампы.
Разница между ксеноном и биксеноном
- Биксенон в одном корпусе совмещает и дальний, и ближний свет.
- В биксеноне переключение проводится механизмом, который способен менять направление света.
- Биксенон стоит дороже, чем ксенон.
Распространённость
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см3 ксенона.
В Солнечной системе
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли, хотя содержание изотопа 129Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. В атмосфере Юпитера, напротив, концентрация ксенона необычно высока — почти в два раза выше, чем в фотосфере Солнца.
Земная кора
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133Xe и 135Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Изотопы
Для ксенона известны изотопы с массовыми числами от 110 до 147, и 12 ядерных изомеров. Из них стабильными являются изотопы с массовыми числами 124, 126, 128, 129, 130, 131, 132, 134, 136. Остальные изотопы радиоактивны, самые долгоживущие — 127Xe (период полураспада 36,345 суток) и 133Xe (5,2475 суток), период полураспада остальных изотопов не превышает 20 часов. Среди ядерных изомеров наиболее стабильны 131Xem с периодом полураспада 11,84 суток, 129Xem (8,88 суток) и 133Xem (2,19 суток).
Изотоп ксенона с массовым числом 135 (период полураспада 9,14 часа) имеет максимальное сечение захвата тепловых нейтронов среди всех известных веществ — примерно 3 миллиона барн для энергии 0,069 эВ, его накопление в ядерных реакторах в результате цепочки β-распадов ядер теллура-135 и иода-135 приводит к эффекту так называемого отравления ксеноном (см. также Иодная яма).
Ксенон-135
Ксенон-135 является радиоактивным изотопом из ксенона , получают в качестве продукта деления урана. Она имеет период полураспада около 9,2 часов и является самым мощным известным нейтрон абсорбирующий ядерный яд (имеющий поглощения нейтронов сечение 2 млн сараях ). Общий выход ксенона-135 от деления составляет 6,3%, хотя большая часть этого продукта является результатом радиоактивного распада теллура-135 и йода-135, образующегося при делении . Xe-135 оказывает существенное влияние на работу ядерного реактора ( ксеноновая яма ). Некоторые атомные электростанции в небольших количествах выбрасывают его в атмосферу.
Свойства
Физические
Гранецентрированная кубическая структура ксенона
Температура плавления −112 °C, температура кипения −108 °C, свечение в разряде фиолетовым цветом.
Заполненная ксеноном газоразрядная трубка
Химические
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона, ксеноновая кислота и другие.
Первое соединение ксенона было получено Нилом Барлеттом реакцией ксенона с гексафторидом платины в 1962 году. В течение двух лет после этого события было получено уже несколько десятков соединений, в том числе фториды, которые являются исходными веществами для синтеза всех остальных производных ксенона.
В настоящее время описаны фториды ксенона и их различные комплексы, оксиды, оксифториды ксенона, малоустойчивые ковалентные производные кислот, соединения со связями Xe-N, ксенонорганические соединения. Относительно недавно был получен комплекс на основе золота, в котором ксенон является лигандом. Существование ранее описанных относительно стабильных хлоридов ксенона не подтвердилось (позже были описаны эксимерные хлориды с ксеноном).
Реакции со фтором:
-
- Xe+F2→XeF2{\displaystyle {\mathsf {Xe+F_{2}\rightarrow XeF_{2}}}} при комнатной температуре и УФ-облучении или при 300—500ºС, p
-
- Xe+2F2→XeF4{\displaystyle {\mathsf {Xe+2F_{2}\rightarrow XeF_{4}}}} при 400ºС, р; примеси XeF2, XeF6
-
- Xe+3F2→XeF6{\displaystyle {\mathsf {Xe+3F_{2}\rightarrow XeF_{6}}}}при 300ºС, р; примесь XeF4
Как установить
Если куплен неполный комплект для ксеноновых источников света, стоит отложить установку до приобретения всех недостающих частей. К примеру, без автокорректора свет распространяется под неправильным углом к дорожному полотну, что ухудшает видимость.
Правила установки ксенона в фары:
- Перед работой проверить каждый элемент комплекта на повреждения. При наличии сколов или царапин установка невозможна.
- Установку рекомендуется проводить сухими и чистыми руками.
- Каждое соединение необходимо изолировать и спрятать. Им требуется надежная защита от влаги и механических воздействий.
- Запрещается долго смотреть на свет ксеноновых ламп – это может нанести вред зрению
- Перед установкой следует отсоединить провод от плюсовой клеммы батареи.
Перед снятием галогеновых ламп необходимо убрать защитную крышку фар, затем отсоединить контактные провода от источника света и вытащить его.
Порядок установки ксенона:
Новую лампу осторожно извлечь из защитной колбы и вставить в отверстие. Нельзя дотрагиваться до самой колбы
При наличии фиксирующей пружинки, которая удерживала галогеновый источник света, ее необходимо примять. Провода от фары будут протянуты сквозь нее и выведены в подкапотное пространство через заглушку. Поскольку со стороны батареи это сделать будет намного легче, ее лучше снять.
После монтажа лампы подключить ее к блоку розжига.
Создание отверстий в заглушках фар, чтобы протянуть провода. Их делают диаметром 25 мм.
Подобрать место для монтажа устройства розжига. Его располагают ближе к фарам, чтобы провода были натянуты. Место установки должно быть вдали от источников нагрева.
Закрепить блок винтами или хомутами.
Соединить проводку от ксеноновых ламп и блока. Каждый провод окрашен в свой цвет, поэтому перепутать их невозможно.
Установка биксеноновых фар требует подключения контроллера напряжения. Элемент подводят к питанию блока розжига.
Устройство ксеноновой лампы.
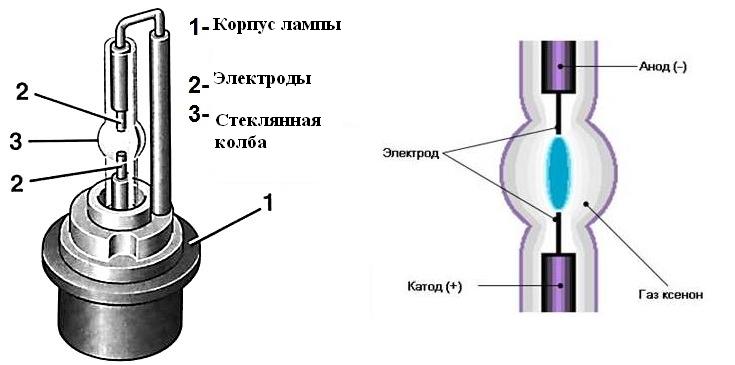
Конструкция ксеноновой лампы.
Ксеноновая дуговая лампа (КДЛ) светит за счет появления электрической дуги в колбе в атмосфере ксенона. Конструкция довольно простая: стеклянная колба, электроды и корпус, в котором все закреплено.
Колба изготавливается из кварцевого стекла. Только такое стекло выдерживает высокое давление (до 30 атмосфер в нерабочем состоянии и 120 атмосфер при свечении) и температуру, которые необходимы для работы лампы. Некоторые колбы для особых назначений производят из сапфира. Он расширяет спектральный диапазон излучаемого света и увеличивает срок службы КДЛ.
В зависимости от назначения колба имеет разные формы: трубка, U-образная, спираль, шар.
Электроды изготавливаются из тугоплавкого вольфрама, который легируется торием. Добавка тория повышает скорость разгорания лампы. Чтобы снизить разницу в коэффициентах теплового расширения вольфрама и стекла, применяют специальный буферный сплав: инвар (смесь никеля и железа). С одной стороны он вплавляется в колбу, а с другой – в него вваривают электроды. Также вольфрамовые электроды соединяются с конденсатором в корпусе лампы. Конденсатор имеет заряд высокого напряжения, доходящий до 2000 В.
В некоторые модели КДЛ встраивают третий разжигающий электрод. Он предназначен для первоначальной ионизации ксенона и запуска разряда лампы.
При работе анод очень сильно нагревается, поэтому для мощных КДЛ конструкцией предусмотрено охлаждение. Источники света мощностью до 4 кВ охлаждают воздухом, а свыше – воздухом и водой.
Распространённость[править | править код]
Ксенон — весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086—0,087 см3 ксенона.
В Солнечной системеправить | править код
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0,08 миллионной доли, хотя содержание изотопа 129Xe на Марсе выше, чем на Земле или Солнце. Поскольку данный изотоп образуется в процессе радиоактивного распада, полученные данные могут свидетельствовать о потере Марсом первичной атмосферы, возможно, в течение первых 100 миллионов лет после формирования планеты. В атмосфере Юпитера, напротив, концентрация ксенона необычно высока — почти в два раза выше, чем в фотосфере Солнца.
Земная кораправить | править код
Ксенон содержится в земной атмосфере в крайне незначительных количествах, 0,087 ± 0,001 миллионной доли по объёму (мкл/л), или 1 часть на 11,5 млн. Он также встречается в газах, выделяемых водами некоторых минеральных источников. Некоторые радиоактивные изотопы ксенона, например 133Xe и 135Xe, получаются в результате нейтронного облучения ядерного топлива в реакторах.
Химические свойства
Водой бурно гидролизуется до триоксида ксенона и плавиковой кислоты в три этапа. Все промежуточные продукты гидролиза выделены в индивидуальном состоянии:
-
- XeF6 + H2O → XeOF4 + 2 HF
- XeOF4 + H2O → XeO2F2 + 2 HF
- XeO2F2 + H2O → XeO3 + 2 HF
При растворении в жидком фтороводороде происходит частичная диссоциация:
-
- XeF6 + HF ⇄ XeF5+ + HF2−
Гексафторид ксенона является достаточно сильной кислотой Льюиса. В присутствии фторид-ионов возможно протекание следующих реакций:
-
- XeF6 + F− → [XeF7]−
- [XeF7]− + F− → [XeF8]2−
Например, вещество легко реагирует с фторидами щелочных металлов (кроме LiF):
-
- XeF6 + RbF → Rb[XeF7]
Однако при нагревании таких солей выше 50 °C происходит разложение:
-
- 2 RbXeF7 → XeF6 + Rb2[XeF8]
Соединения состава M2XeF8 достаточно устойчивы. Например, натриевое производное устойчиво до 100 °C, а цезиевое — до 400 °C.
С фторидами менее активных элементов гексафторид ксенона образует двойные соли, которые впервые получили ещё в 1967 году. Например, были получены 4XeF6·GeF4, 2XeF6·GeF4 и XeF6·GeF4, но получить аналогичное соединение с фторидом кремния не удалось, за счёт слабой основной функции SiF4. Вещество также взаимодействует с BF3 и AsF5 в соотношении 1:1. При этом образуются белые устойчивые кристаллы, слаболетучие при комнатной температуре (давление паров составляет около 1 мм.рт.ст). XeF6·BF3 плавится при 80 °C с образованием жёлтой вязкой жидкости.
Также были сообщения о получении высшего фторида XeF8 из XeF6 и F2, однако эти данные не подтвердились. Существование октафторида ксенона не возможно из-за размера атома ксенона: атомы фтора были бы очень близко расположены относительно друг друга, и сила отталкивания одноименных зарядов была бы больше энергии связи Xe-F.
Применение
Ксеноновая лампа-вспышка
Прототип ионного двигателя на ксеноне.
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы (127Xe, 133Xe, 137Xe и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
- В конце XX века был разработан метод применения ксенона в качестве средства для наркоза и обезболивания. Первые диссертации о технике ксенонового наркоза появились в России в 1993 г. В 1999 году ксенон был разрешён к медицинскому применению в качестве средства для ингаляционного наркоза.
- В наши дни[уточнить] ксенон проходит апробацию в лечении зависимых состояний.
- Жидкий ксенон иногда используется как рабочая среда лазеров.
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а также в качестве компонентов газовых смесей для лазеров.
- В изотопе 129Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния, называемого гиперполяризацией.
- Для , проявляющего сильные окисляющие свойства.
Применение ксенона:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Xenon
- https://de.wikipedia.org/wiki/Xenon
- https://ru.wikipedia.org/wiki/Ксенон
- http://chemister.ru/Database/properties.php?dbid=1&id=264
- https://chemicalstudy.ru/ksenon-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
карта сайта
ксенон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле ксенона ксенонсколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
1 028
История[править | править код]
Открыт в 1898 году британскими учёными Уильямом Рамзаем и Морисом Траверсом, которые подвергли медленному испарению жидкий воздух и спектроскопическим методом исследовали его наиболее труднолетучие фракции. Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Происхождение названияправить | править код
Рамзай предложил в качестве названия элемента древнегреческое слово ξένον, которое является формой среднего рода единственного числа от прилагательного «чужой, странный». Название связано с тем, что ксенон был обнаружен как примесь к криптону, и с тем, что его доля в атмосферном воздухе чрезвычайно мала.






